Das Blaue Pigment hat mich ja in seinen Bann gezogen. Nach ersten Erfolgen mit Japanischem Färberknöterich (oft abgekürzt als JFK, aber nicht zu verwechseln mit einem gewissen Präsidenten) wollte ich es nun auch mit der einheimischen Pigmentquelle versuchen: dem Färberwaid. Das Prinzip sollte das gleiche sein wie mit JFK: Blätter ernten, mit Wasser bedecken und eine Weile stehen lassen (Fermentation), Blätter zum richtigen Zeitpunkt entfernen, Alkalisieren und Belüften, um das Pigment zu bilden und zu fällen, setzen lassen, fertig.
Theoretisch.
Wie ich lernen durfte, steckt aber doch etwas mehr dahinter. Und ich erlaube mir an dieser Stelle einen Disclaimer: Nach dem Lesen des Artikels könnte es sein, dass Du das unstillbare Verlangen hast, Waid anzubauen. Ich lehne jegliche Verantwortung dafür ab und verweise auf den Abschnitt Literatur und weitere Quellen am Ende des Artikels. Und nun viel Spaß beim Lesen!
Der Färberwaid und sein Pigment
Die Pflanze
Färberwaid (Isatis tinctoria) ist eine zweiährige, eher unscheinbare rosettenbildende Pflanze, die eine Pfahlwurzel ausbildet. Im ersten Jahr bildet sie Blätter und im zweiten Jahr dann einen Blütenstand (Kreuzblüter), aus dem wieder Samen gewonnen werden können. In manchen Gegenden z. B. der USA gilt Waid als invasiv und darf dort nicht angebaut werden.

Der Farbstoff (bzw. die Vorstufen) sitzen in den Blättern, die mehrmals im Jahr geerntet werden können. Die Quellen sind sich allerdings nicht einig, wann der beste Zeitpunkt ist. Schweppe sagt auf S. 295 „Man beginnt mit ihrem Einsammeln im Juni des zweiten Jahres nach ihrer Aussaat“, die meisten anderen jedoch empfehlen hingegen die Blätter aus dem ersten Jahr.
Das Pigment
Wir erinnern uns: Das Indigo liegt in den Pflanzen als Vorstufe vor (z. B. als Indican, Isatin A oder Isatin B). Bei der Fermentation wird aus der Vorstufe durch die Arbeit von Enzymen das Indoxyl freigesetzt, das ist quasi eine Hälfte des Indigo-Moleküls. In Anwesenheit von Sauerstoff und im Alkalischen können daraus Indigotin (der blaue Farbstoff), Indigorubin (ein rötliches Isomer von Indigotin) und das Isatin (ein orange-gelber Farbstoff, der quasi auch nur eine Hälfte des Indigotins enthält) entstehen. Meist liegen im Indigopigment auch alle diese Moleküle in veränderlichen Gewichtsanteilen nebeneinander vor. Das macht genau den Charakter des natürlichen Indigopigments aus (im Gegensatz zum chemisch synthetisierten, das fast nur das Indigotin enthält). Ein hoher Anteil von Indigotin im Pigment ist dabei ein gewisses Qualitätsmerkmal. Waid enthält weniger Indigo (bzw. Indigovorstufen) als beispielsweise echter Indigo.
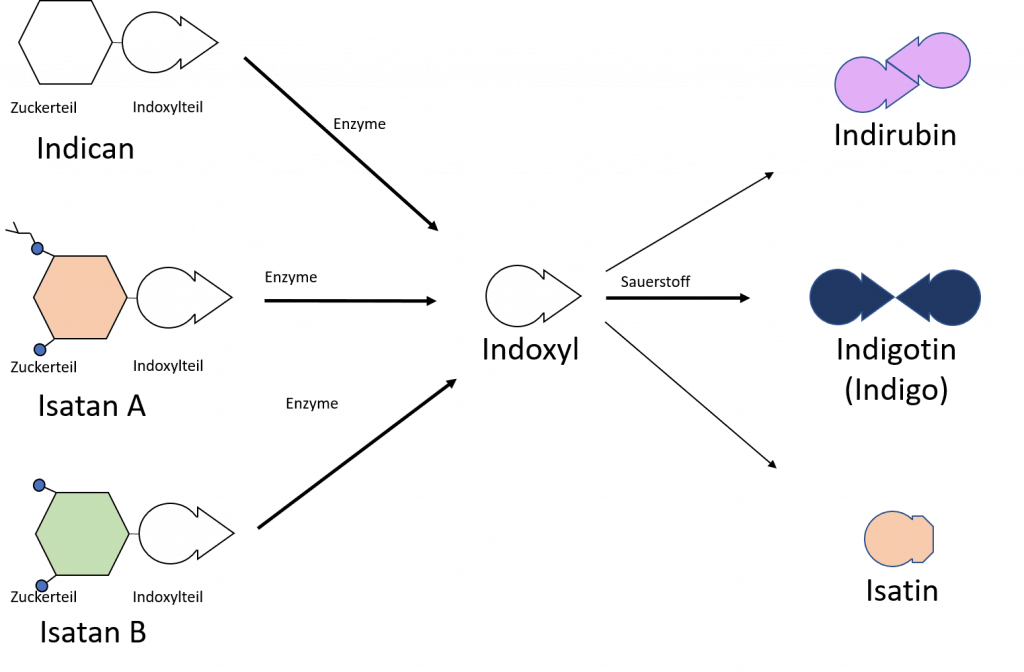
Die Blätter des Färberwaids enthalten also die Vorstufe des Indigo. Während der Japanische Färberknöterich Indican enthält, liegen im Waid überwiegend Isatan A und Isatan B vor (wobei Isatan A den Hauptteil darstellt, siehe D. Cardon S. 337 ff). Diese Erkenntnisse sind sogar noch recht neu – erst im Jahre 2004 wurde die genaue Struktur von Isatan B von Oberthür et al. aufgeklärt.
Die Spaltung der Vorstufe ist für Isatan etwas anders als für Indican, aber sobald das passiert ist, ist die Chemie die gleiche wie bei den anderen Indigopflanzen auch. Das Spaltprodukt, das wir für das Indigo brauchen, ist das Indoxyl, das dann in Anwesenheit von Sauerstoff und im Alkalischen weiterreagiert zu Indigotin.
Färberwaid früher und heute
Ich bin historisch wirklich nicht gut bewandert und bringe Zahlen immer fürchterlich durcheinander. Aber so viel sei gesagt: Waid hat früher eine enorme Rolle gespielt. Klassisches Anbaugebiet in Deutschland war Thüringen, Thüringer Waid zeichnete sich offenbar durch eine besonders gute Qualität aus. Ab dem 17. Jh verdrängte der aus Übersee importierte Indigo mit seiner tieferen Farbe und höheren Ausbeute den Waid als Quelle für blauen Farbstoff, und wurde selbst später von synthetisch hergestelltem Indigo verdrängt.
Traditionell hat man in Thüringen in Waid-Mühlen aus den Blättern Waidbälle gemacht. Die Blätter wurden gewaschen, gequetscht und zu Bällen geformt. Die Bälle wurden getrocknet und gelagert und konnten später mit Wasser und Urin zur Gärung gebracht werden, um Küpen anzusetzen und zu färben.
Auf die Techniken und Hintergründe möchte ich an dieser Stelle aber gar nicht eingehen. Wenn Du Dich dafür interessierst, empfehle ich Dir z. B. das Buch „Natural Dyes“ von Dominique Cardon oder „Die Textilfärberei vom Spätmittelalter bis zur frühen Neuzeit“ von Sabine Struckmeier.
Die letzte Waidmühle Deutschlands schloß wohl Anfang des 20.Jh ihre Tore. Heute wird nur noch in kleinem Maßstab Waid angebaut und unter Erfurter Blau zum Färben eingesetzt und vermarktet. Die Inhaberin gibt auch Workshops zum Thema Waid, und offenbar wird demnächst ein Crowdfunding gestartet, um einen Trickfilm zu schaffen, der Waid und seine Verarbeitung erklären soll.
Vor dem Hintergrund der Nachhaltigkeit und der Umweltbelastung durch Küpen mit synthetischen Reduktionsmitteln gab es von 2000 bis 2004 ein EU-gefördertes Projekt namens SPINDIGO (Sustainable Production of Plant-Derived Indigo, den finalen Projekt-Bericht gibt es hier). Darin wurde die Machbarkeit (d. h. Wirtschaftlichkeit) eines Revivals des Waid-Anbaus in verschiedenen Ländern Europas untersucht. Die Ergebnisse waren durchaus hoffnungsvoll, aber leider ist daraus nichts Weiterführendes hervorgegangen.
Waid ist anders als Japanischer Färberknöterich
Die im Waid vorhandene Indigovorstufe ist das Isatan (s. o.). Im „Handbook of Natural Colorants“ fand ich nun interessante Hinweise zu experimentellen Bedingungen, die die Ausbeute für die Pigmentgewinnung aus Isatanen erhöhen sollen. Ich lasse die ganze Chemie mal weg und sag nur: Säure. Die Spaltung der Isatane geht wohl im Sauren besonders gut, und zusätzlich stabilisiert die Säure das Spaltprodukt Indoxyl (vor dem Belüften und Alkalisieren). Das Indican hingegen (also die Vorstufe aus dem JFK) ist leichter im Alkalischen zu spalten.
Ein zweiter interessanter Hinweis war die Verwendung von heißem Wasser, mit dem die Blätter anfangs übergossen wurden, bevor der Ansatz dann bei Raumtemperatur weiter inkubiert wurde. Diese Variante wurde in der Literatur speziell für Waid empfohlen.
Diese beiden Bedingungen wollte ich also in mein Experiment einfließen lassen. Und wie ich feststellen musste, unterscheiden sich Waid und Färberknöterich in weiteren Punkten…aber dazu weiter unten mehr.
Meine ersten Versuche mit Waid
Meine Samen gingen gut auf und die 3 Pflanzen wuchsen gut an. Als ich im Juli meine zweite Extraktion des Jahres mit JFK ansetzte, schnitt ich ein paar Blätter Waid mit ab und setzte eine separate kleine Waid-Extraktion mit kaltem Wasser an.
Schon an dieser Stelle kamen die ersten Unterschiede zutage. Die Waid-Fermentation blieb einfach mal fast farblos bis blassgrün. Ich schloss daraus, dass mein Waid vielleicht (noch) keinen Farbstoff enthielt – vielleicht war ja der Topf zu klein, die Pflanzen noch zu jung, oder ich hatte nicht richtig gedüngt? Etwas enttäuscht und verwirrt kippte ich die Fermentation ohne Alkalisieren in die Büsche. Naja, ich hatte wenigstens ein bißchen blau vom JFK.
Zum Vergleich: Beim JFK wird die Flüssigkeit nach 1 – 4 Tagen neonfarben (auf englisch wird oft von mermaid-colour oder anti-freeze colour gesprochen) und zeigt mir an, dass es Zeit wird, die Fermentation zu beenden, zu alkalisieren und zu belüften.
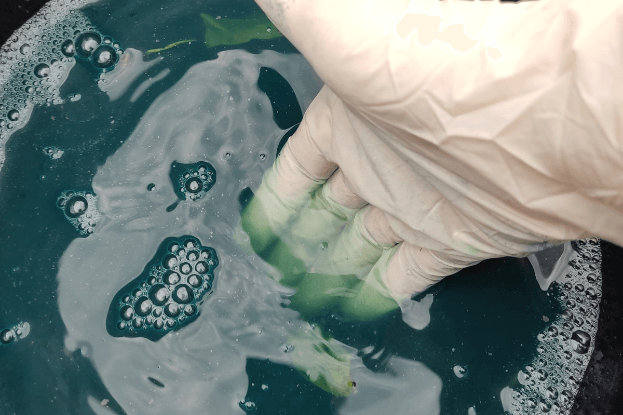

Dann fiel mir ein, wie ich ganz schnell testen könnte, ob die Blätter überhaupt schon blauen Farbstoff enthielten: Ich muss einfach nur ein Blatt zwischen zwei Küchentücher legen und draufhämmern! Gesagt, getan und siehe da: das Blatt roch arg komisch und blieb stur grün. Wo war nur der Farbstoff?
Ich probierte weiter mit der Hammer-Methode: altes Blatt vs. junges Blatt. Aha! Ein junges Blatt wurde ganz ganz leicht blau am Stängelansatz! Ich muss also junge Blätter nehmen!

Eine systematische Versuchsreihe
Diese Ergebnisse standen nun in komplettem Gegensatz zu dem, was andere herausgefunden hatten. Anne von yellowobjects berichtete, dass bei ihr die älteren Blätter mehr Farbstoff enthielten.
Es wurde Zeit, das Ganze etwas systematisch anzugehen. Die Frage „alte vs. junge Blätter“ kombinierte ich mit der Frage „sauer oder neutral fermentieren“, und so setzte ich folgenden Mini-Versuch in Einweckgläsern an:
- alte Blätter neutrale Fermentation
- alte Blätter saure Fermentation
- junge Blätter neutrale Fermentation
- junge Blätter saure Fermentation
Zum Ansäuern in 2 und 4 gab ich einfach einen Schluck Essigessenz ins Glas (pH war dann ca. 3)

Meine Erwartung war: wenn überhaupt, dann sehe ich bei den jungen Blättern etwas Pigment, und wenn die Literaturangaben stimmen, dann im Sauren mehr als im Neutralen.
Und so wartete ich und beobachtete meine Gläser. In der Literatur wurde eine Extraktion von 2 bis 4 h beschrieben, ich war gespannt, was „mein“ Waid in dieser Zeit machen würde.
Nach 1,5 h hielt ich es nicht mehr aus und führte einen ersten Fällungstest mit kleinen Mengen Flüssigkeit in Reagenzgläsern durch. Ich gab ein Spatelspitzchen Ca(OH)2 hinzu (=Alkalisieren), verschloß das Glas mit einem Stopfen und schüttelte (=Belüften). Und siehe da: überall wurde etwas Pigment ausgefällt! Das war doch durchaus vielversprechend.

Ich inkubierte tapfer weiter und hoffte auf irgendwas neonfarbiges oder einen metallischen Film an der Oberfläche. Nach 8h war immer noch nichts in diese Richtung passiert. Da ich nun schon deutlich über der empfohlenen Zeit war, entschloss ich mich, die Fermentation zu beenden und das Pigment zu fällen.
Ich gab eine großzügige Spatelspitze (und damit vermutlich viel zu viel) Ca(OH)2 zu jedem Glas und schüttelte ca. 30 Sekunden. Und siehe da: überall fiel etwas aus, und es gab in allen Gläsern einen Farbumschlag von gelblich nach grün! Entgegen meinen Erwartungen wurde also auch aus den älteren Blättern Pigment gefällt. Wer hätte das gedacht!

Nachdem sich das Pigment gesetzt hatte, sah es sogar blaugrün aus, der Überstand darüber war gelb. Grünblau ist zwar nicht die Zielfarbe, aber der Überstand war sehr gelb, und gelb + blau = grün, oder?

Eine Frage führt zur nächsten…
Nun, das Pigment war da, aber blau… so richtig blau war es nicht. Eher so potentiell blau. Wenn ich die Informationen aus der Facebook-Gruppe richtig interpretiert habe, dann deutet Grünblau wohl darauf hin, dass der Ansatz überfermentiert war und auch Flavonoide und deren Abbauprodukte mit gefällt wurden. Also doch gelb + blau = grün. Naja. Und schon formte sich das nächste Experiment in meinem Kopf…
Da ich in meiner Küche keine Möglichkeit habe, die chemische Natur des Pigments näher zu untersuchen, wollte ich ihm auf andere Weise auf die Spur kommen. Mir stellten sich zwei Fragen:
- Wenn ich das grünblaue Pigment intensiv wasche, bis der Überstand klar ist, wird es dann blauer (nach der Rechnung grün – gelb = blau)?
- Ist das Pigment reduzierbar und kann man damit Wolle färben?
Und so schlossen sich nahtlos zwei Folgeversuche an.
Für den Waschversuch verwendete ich Sedimente 2 und 4 (die saure Extraktion). Das Waschen des Pigments aus Glas Nr. 2 mit Wasser (saure Extraktion aus älteren Blättern) war sehr aufwändig, das gelb wurde und wurde nicht weniger. Am Ende war das gewaschene Pigment ein bisschen weniger grün und ein bisschen mehr blau, aber indigo-blau war es definitiv nicht.

In einem letzten Wasch-Schritt habe ich dann etwas Weißweinessig zugesetzt, um auch die letzten Reste kalkhaltiger Verunreinigungen zu entfernen. In der Literatur wurde zwar Citronensäure verwendet, aber die hatte ich grad nicht da. Aber siehe da: in Reagenzglas 2 wurde blau(er)! Houston, wir haben blaues Pigment!
Der Knaller kam dann, als ich das Pigment aus Ansatz 4 (junge Blätter, saure Extraktion) mit Essig wusch: es wurde kanariengelb. Und nach dem Auswaschen des Essigs mit Wasser wurde es wieder grün. Was immer ich da also aus jungen Blättern extrahiert habe, Indigotin war es wohl nicht…

Die Reduzierbarkeit untersuchte ich mit den Sedimenten aus der neutralen Extraktion (Sedimente 1 und 3). In kleinen Gläsern resuspendierte ich das Pigment aus Glas 1 (ältere Blätter) und Glas 3 (jüngere Blätter) mit etwas von dem alkalisierten Überstand, der nach der Extraktion übrig geblieben war. Vorsichtig streute ich eine Spatelspitze Entfärber aus dem Drogeriemarkt darüber (das ist Natriumdithionit, ein starkes Reduktionsmittel). Und siehe da: In beiden Gläsern gab es einen Farbumschlag von grün zu gelb! Meine Pigmente waren also reduzierbar.
Allerdings gab immer noch keinen metallischen Schimmer an der Oberfläche, so wie es in den Anleitungen steht. Dass mein Pigment reduzierbar war, heißt noch nicht, dass es auch Indigo ist. Dafür muss es bei der Re-Oxidation blau werden. Ich legte also für 20min ein kleines Strängchen Wolle in die Gläser ein und wartete gespannt. Und siehe da: der Strang aus Glas 1 wurde an der Luft wieder ganz leicht grün!
Yeah, das Pigment ist reduzierbar und oxidierbar!
Ein zweiter Dip brachte leider keine signifikante Vertiefung der Farbe, und in Glas 3 konnte ich überhaupt keine Färbung der Wolle sehen. Vielleicht war es einfach zu wenig Pigment. Oder eben nicht das richtige (in den Waschversuchen wurde das Pigment ja auch kanariengelb statt blau).
Am nächsten Tag hatte sich in Glas 1 die Oberfläche des Bodensatzes an Pigment schon wieder grünblau gefärbt, es war also schon teilweise zurückoxidiert, während das in Glas 3 noch gelb blieb.
Ein letztes Experiment
Eins ließ mir jedoch keine Ruhe, und ich musste es wissen: Erscheint irgendwann dieser metallische Schimmer auf der Oberfläche des Fermentationsansatzes, der das Pigment anzeigt? Wie verändert sich die Fermentation über die Zeit? Was sehe ich, was rieche ich?
Also schnitt ich noch ein paar mehr Blätter ab und setzte wieder eine kleine Fermentation an, dieses Mal mit kaltem Wasser. Ich wollte einfach nur eine kleine Zeitreihe machen.
Nach 24h beobachtete ich leichte Schaumbildung auf der Oberfläche, einen (unangenehmen) vergorenen Pflanzengeruch und definitiv keine schimmernde Oberfläche. Ein Fällungsversuch brachte ganz leicht hellblaues Pigment.


Nach 48 h roch der Ansatz wirklich übel, es hatte sich eine schimmernde Haut gebildet. Ein erster Hinweis auf Pigment! Die Flüssigkeit war aber sehr trüb, und die Fällung brachte einen eher bräunlichen Niederschlag.


Nach 36h war der Gestank phänomenal, alles war nur noch eine trübe Brühe und der Niederschlag war graubraun. Kein Blau. Nur Bäh.


Ergebnisse
1) Die Fermentationsdauer ist sehr kurz. Die Waid-Fermentation braucht selbst mit kaltem Wasser im August (tagsüber ca. 30°C) deutlich weniger als 1 Tag bis zur Reife. Man müsste das mal im 2h-Abstand testen…
2) Warte nicht auf den Schimmer. Ein Schimmer erschien bei mir erst, als der Ansatz deutlich überfermentiert war. Der beobachtete Film könnte auch einfach eine Kahmhaut sein. Vermutlich ist in so kleinen Ansätzen auch zu wenig Farbstoff für einen Film enthalten.
Was habe ich gelernt?
Eine Menge.
- Es geht! Mein Waid enthält Indigo. Sogar die alten Blätter.
- Die Fermentation sieht ganz anders aus als die mit Japanischem Färberknöterich. All die visuellen und olfaktorischen Marker, die ich gesetzt hatte in meinem Gehirn, funktionieren nicht für Waid. Für Waid muss ich neue Marker setzen.
- Beobachten und interpretieren. Ich muss mich darin üben zu schauen, ob die Annahmen und Erwartungen, mit denen ich in den Versuch gegangen bin, wirklich zutreffen oder nicht. Üben, ergebnisoffen zu experimentieren und nicht voreilig Schlüsse zu ziehen, die meine Annahmen bestätigen.
- Mein Waid war nach 8h offenbar überfermentiert. Nächstes Mal kürzer fermentieren (oder einen kalten Ansatz machen oder beides).
- Ich brauche mehr Waid.
- Ich LIEBE Experimente.
- Youtube ist mein Freund. Auch VOR dem Experimentieren.
Darauf achte ich beim nächsten Versuch
Blauschimmer an Grenzflächen. In einem youtube-Video wurde gezeigt, dass man an den Grenzflächen der Flüssigkeit manchmal einen Blauschimmer sehen kann. Ich vermute aber, dass mein Mini-Ansatz dafür zu wenig Pigment enthielt und ich diesen Schimmer deshalb nicht sehen konnte. Offenbar enthält Waid auch deutlich andere Pigmente als Japanischen Färberknöterich und somit ist der Überstand natürlich auch anders gefärbt. Hinzu kommt, dass Waid deutlich weniger Pigment(vorstufen) enthält und somit die anderen Pigmente alles überdecken, was man bei JFK so schön sehen kann.
Blauer Schaum und langes Belüften. Das einzige wirklich sichere Zeichen für Pigment ist offenbar der blau werdende Schaum beim Belüften (und auch das ist bei ganz kleinen Ansätzen nicht immer gegeben). In meinen Gläsern (und auch den Reagenzgläsern) war intensives Belüften nicht gut möglich, sodass dieser Teil des Experimentes vermutlich suboptimal verlaufen ist. In einem größeren Ansatz sollte das besser funktionieren.
Hast Du schon mal mit Waid gearbeitet? Wie sind Deine Erfahrungen?
Literatur und Quellen
H. Schweppe “Handbuch der Naturfarbstoffe” (1993). Nicol Verlagsgesellschaft mbH & Co. KG, Hamburg. ISBN 3-933203-46-5
“Handbook of Natural Colorants” 2nd Ed. (2023). Wiley. ISBN 9781119811718
Dominique Cardon “Natural Dyes. Sources, Tradition, Technology and Science”. (2007).Archetype Publications Ltd. ISBN 978-1-904982-00-5.
Sabine Struckmeier “Die Textilfärberei vom Spätmittelalter bis zur Frühen Neuzeit (14.-16.Jh). Eine naturwissenschaftlich-technische Analyse deutschsprachiger Quellen.”(2011). Waxmann.ISBN 978-3-8309-2527-9
Jenny Dean, Karen Diadick Casselman “Wild Color” (2010). Watson-Guptill Publications. ISBN 978-0-8230-5879-2
Fibershed hat einen wunderbaren Guide:
http://fibershed.org/wp-content/uploads/2018/01/indigo-planting-harvesting-nov2017.pdf
Facebook-Gruppe zur Pigmentextraktion https://www.facebook.com/groups/indigopigmentextractionmethods/
Blogbeiträge
Achtung, keine Https-Verbindung:
http://blog.kirsten-koester.de/2009/05/22/zweijahriger-waid/
Youtube
https://youtu.be/llaesV8Pbq4?si=oQ9BFzTsxCJ4WlIj
https://youtu.be/C-VZyygvwbc?si=kciduXcVcvq714Oa
https://youtu.be/objcrgLQq60?si=bpiAqrErLrZgUFcS
Saatgutquelle:
https://www.stillgarments.com/shop/saatgut/faerberpflanzen-saatgut-set/.

Schreibe einen Kommentar